Der Traum von fetten Algen
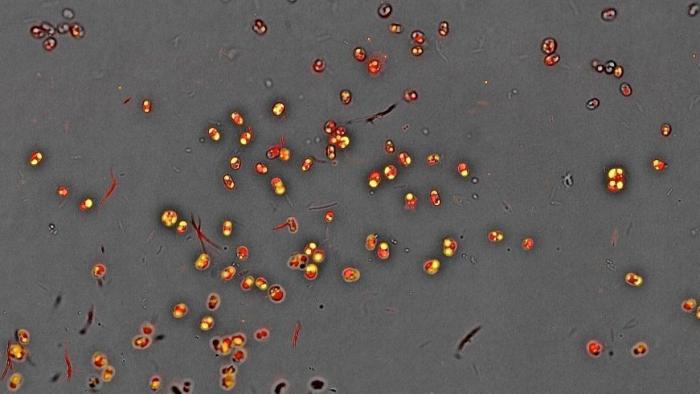
Ölanreicherung in Nannochloropsis-Algen, konfokale Mikroskopie. Rot - Chlorophyll, gelb - Öl. Für die meisten Algen in der Abbildung macht das Öl einen beträchtlichen Teil des Zellvolumens aus. Bild: Elisa Corteggiani/CC BY-SA 3.0
Von den Besonderheiten der Biokraftstoffgewinnung aus Mikroalgen
Während sich die jüngsten Entwicklungen des Ölpreises hemmend auf die Arbeit an Biokraftstoffen auswirkte, liegt das größte Hindernis für deren Produktion im kommerziellen Maßstab bei den Herstellungskosten, die eine Folge grundlegender biologischer Sachzwänge sind. Zwar sind die Prognosen vieler Beteiligter deutlich zurückhaltender als noch vor zehn Jahren, doch wird der Traum von Biokraftstoffen aus Mikroalgen nach wie vor von Medien und Industrie am Leben erhalten.
Die Autoren der Biofuelwatch-Studie "Microalgae Biofuels - Myth and Risks" haben vier Mythen isoliert, die dabei häufig bemüht werden, obwohl sie einer gründlicheren Betrachtung nicht standhalten:
- Mikroalgen produzieren Biokraftstoffe lediglich aus Sonnenlicht, Wasser und Kohlendioxid.
- Mikroalgen können bei geringem Flächenbedarf große Mengen an Kraftstoff produzieren.
- Mikroalgen-Kraftstoffe sind eine klimafreundliche Alternative zu ihren fossilen Pendants und können zur Abscheidung und zum Recycling von Kohlenstoff verwendet werden oder gar zu "kohlenstoff-negativen" Kraftstoffen werden.
- Der Einsatz kommerzieller Mikroalgen-Biokraftstoffe steht unmittelbar bevor.
Das Wachstum von Mikroalgen ist stark abhängig von der Verfügbarkeit von Nährstoffen. Sollen Kraftstoffe in kommerziellen Größenordnungen hergestellt werden, müssten beträchtliche Nährstoffmengen bereitgestellt werden. Zwar ist aus der Abwasserbehandlung die Fähigkeit von Algen bekannt, effektiv Nährstoffe aus Abwässern entfernen zu können. Doch ist dieser Prozess nicht unmittelbar auf die Biokraftstoffherstellung übertragbar, die Monokulturen und kontrollierte Bedingungen bei gleichzeitiger Vermeidung einer Kontamination durch die Schadstofffracht erfordern.
Große Mengen Wasser sind notwendig, bei dem außerdem Anforderungen an verschiedene Parameter wie pH-Wert oder den Salzgehalt zu berücksichtigen sind, je nach gewählter Mikroalge. Einige Studien gehen von mehr als 3000 Liter Wasser für jeden erzeugte Liter Biokraftstoff aus. In Gegenden mit optimaler Sonneneinstrahlung und Temperatur stehen oftmals nur begrenzte Wasservorkommen zur Verfügung. Marine Mikroalgen können in Meerwasser kultiviert werden, doch birgt das die Gefahr, dass Konkurrenten, Räuber oder Krankheiten eingeschleppt werden.
Für ein maximales Mikroalgen-Wachstum sind größere Mengen an Kohlendioxid nötig. Das Problem: In der Luft liegt das Gas nur sehr verdünnt vor. Es muss angereichert oder in Form löslicher anorganischer Karbonate bereitgestellt werden. Mit der Photosynthese steigt der pH-Wert, der wiederum Einfluss auf die Verfügbarkeit des Kohlendioxids hat.
Auch die richtige Versorgung mit Licht ist eine Frage des Optimums. Algen haben im Laufe der Evolution die Fähigkeit erworben, Licht über einen breiten Spektralbereich ausnutzen zu können, was ihnen bei Bedingungen zugute kommt, die das Eindringen des Lichts in die Wassersäule behindern. Stehen die Algen zu dicht, wird das Wachstum der unteren Lagen eingeschränkt. Bekommen sie hingegen zu viel Licht, werden die Zellen beschädigt.
Eine andere Schwierigkeit: der nötige Kompromiss zwischen Algenwachstum und Lipidbildung. Letztere ist das Ziel, sie soll Ersteres nicht ausbremsen. Die mangelnde Kontrolle dieser Balance gilt als eins der größten Hemmnisse auf dem Weg zur Kommerzialisierung.
Das Argument der Herstellung großer Mengen Biokraftstoffe auf kleinen Landflächen, die die Konkurrenz zur Landnutzung für die Nahrungsmittelproduktion oder Beeinträchtigungen der Biodiversität von vornherein ausschließen soll, ist ebenfalls löchrig. Es gilt zum Beispiel nicht für die Kultivierung heterotropher Mikroalgen, die mit Produkten aus dem landwirtschaftlichen Anbau von Monokulturen wie Zuckerrohr ernährt werden.
Und auch der Flächenbedarf zur Kultivierung photosynthetischer Mikroalgen ist beträchtlich. Der ergibt sich aus den durch die Effizienz der Photosynthese auferlegten Beschränkungen, die zu logistischen Problemen derjenigen Projekte führt, die das Kohlendioxid ihren Algen gleich in Werksnähe zuführen wollen. Denn einige Mikroalgen-Unternehmen zapfen mit ihren Algenkulturen den Rauchgas-Ausstoß großer Industriebetriebe der Stahl-, Zement- oder Energiebranche an. Hierzu gesellt sich ein weiteres Problem: Algen, die in einer Rauchgasatmosphäre gedeihen, sind nicht notgedrungen auch die, die den Erwartungen an die Lipidproduktion entsprechen.
Gentechnische Optimierung der Algenstämme
Um die natürlichen, durch die Photosyntheseleistung der verfügbaren Algenstämme gezogenen Grenzen aufzubrechen, versuchen sich die Wissenschaftler an der genetischen Optimierung der Algenphysiologie.
Hierbei kommt eine ganze Palette von Verfahren zum Einsatz, auch neuer: Mikroalgen erfreuen sich wachsender Beliebtheit als Spielplatz moderner Genome Editing-Techniken.
Die Wissenschaftler wollen den Mikroalgen zu einer effektiveren Photosynthese verhelfen, in dem sie das nutzbare Spektrum des Lichts erweitern oder die Fähigkeit zur Lichterfassung verbessern. Das wollen sie unter anderem durch Manipulation des RuBisCO-Enzyms erreichen. Ein anderes Ziel ist die Beeinflussung des schwierigen Spagats zwischen Algenwachstum und Lipidproduktion: die Algen sollen so manipuliert werden, dass sie mehr Lipide erzeugen, ohne dabei zu verkümmern oder einzugehen.
Bisher konnten Mikroalgen durch genetische Veränderungen dazu bewegt werden, unter Laborbedingungen verschiedene Grundchemikalien auszuschwitzen: diverse Kohlenwasserstoffe, Alkohole, Aceton und Fettsäuren. Doch die Überführung in industrielle Prozesse lässt auf sich warten.
Kritiker bemängeln die vereinfachenden Annahmen der genetischen Ingenieure, die der Komplexität der realen biologischen Welt nicht gerecht würden. Die US-Umweltbehörde EPA sieht sich gegenwärtig einem wahren Ansturm neuer Anwendungen ausgesetzt, die ihrer kommerziellen Nutzung harren. Die momentanen EPA-Regeln gestatten Genehmigungen für fast alle Projekte auf Pilot- oder Demonstrationsebene, solange keine offenen Teichanlagen zur Kultivierung der Algen genutzt werden. Fortgeschrittene Firmen wie Solazyme hatten die Genehmigung zur kommerziellen Produktion und die Genehmigung der Lebensmittelbehörde FDA, die an den Produkten aus den GV-Algen nichts zu beanstanden hatte.
2017 schließlich veröffentlichten Wissenschaftler von der University of California San Diego und Sapphire Energy Ergebnisse eines EPA-genehmigten Tests mit GV-Algen in offenen Teichanlagen, Fazit: Die modifizierten Algen finden ihren Weg in die nähere Umgebung.
Das hat Biologen nicht überrascht. Doch es bleiben Fragen: wie weit würden sich entwichene Algen in der Folge verbreiten, und wie lange würden sie überleben? Würden Transgene, die das Wachstum und die Lebenstüchtigkeit einiger GV-Mikroalgen optimieren sollen, sich dann auch über Artengrenzen hinweg ausbreiten, über Lebensräume und ganze Regionen? Und in welchen Zeiträumen?
Die generelle Unkenntnis über den Mikroalgen-Kosmos schließt sachliche Abschätzungen zu belastbaren Szenarien aus, die seiner Komplexität und Dynamik gerecht würden.
Viele damit befasste Wissenschaftler gehen davon aus, dass ein Entweichen von GV-Mikroalgen aus den Kulturen nicht zu vermeiden ist, zu vielseitig sind die Möglichkeiten dafür: Unfälle, winzige Lecks oder Extraktionsprozesse bieten Gelegenheiten hierfür. Einige Mikroalgen sind selbst für ein Abwandern mit dem Wind geeignet. Einmal freigesetzt, könnten sie ihre naturbelassenen Artgenossen beim Wettbewerb um Nährstoffe niederkonkurrieren. Räuber, die mit ihrem Mikroalgenhunger bisher dafür sorgten, dass Algenblüten nicht außer Kontrolle gerieten, könnten angesichts des GV-Algen-Zuzugs ihren Appetit verlieren, denn auch an deren Schmackhaftigkeit wird gearbeitet, um ihnen ein ungestörtes Wachstum zum Zwecke einer ungestörten Chemikalienproduktion zu ermöglichen.
Schadszenarien mit globalen Auswirkungen sind nicht auf GV-Algen beschränkt, auch andere Verwandte haben das Zeug zur Problemalge, beispielsweise wenn sie exotischer Herkunft sind und sich als invasive Art ausbreiten. Weitere neue Risiken lauern im Verlauf künftiger gefährlicher Algenblüten, die unter anderem zur Gefährdung der Trinkwasserversorgung und zum Umkippen ganzer Ökosystemen führen können.
Eine weitere Facette: Monokulturen von Mikroalgen sind anfällig für Invasionen konkurrierender Wildarten, räuberischer Organismen oder Pilzinfektionen. Die Entwickler favorisieren zur Beherrschung dieses Problems Methoden des Pflanzenschutzes, die der modernen industriellen Landwirtschaft entlehnt sind. Zum Beispiel genetisch veränderte Mikroalgen, die Herbizide wie Glyphosat tolerieren können. So erhielt Sapphire Energy 2012 ein Patent für Glyphosat-resistente Mikroalgenstämme.
Algen "fetter" machen: ExxonMobil und Synthetic Genomics
Im Sommer 2017 hatte ExxonMobil einen Durchbruch in der Sparte Biokraftstoffe vermeldet, nämlich mit der Kunde, Algen "fetter" machen zu können. 2009 hatte sich Exxon mit dem kalifornischen Biotech-Start-up Synthetic Genomics zusammengetan, um den Ölgehalt von Nannochloropsis gaditana-Mikroalgen von 20 auf 40 % hochzutreiben.
Synthetic Genomics ist nach eigener Auskunf damit beschäftigt, das Betriebssystem des Lebens zu programmieren, um nachhaltige Lösungen für die dringlichsten Fragen der Menschheit zu schaffen, vom Wohlbefinden der Bevölkerung bis hin zur Gesundheit unseres Planeten.
Das Synthetic Genomics-Team hatte zunächst Gene identifiziert, die die Lipidproduktion in den Zellen steuern. Nach Bearbeitung mit der CRISPR/Cas9-Genschere blieben drei Kandidaten, von denen einer nicht nur bedeutend mehr Lipide produzierte, sondern gleichzeitig die Wachstumsrate nicht-modifizierter Algen beibehielt.
Doch auch bei Exxon ist man sich im klaren, dass der Technologie noch viele Jahre bis zur Kommerzialisierung fehlen. 2013, nachdem das Unternehmen bereits 600 Millionen US-Dollar in Algenkraftstoffe investiert hatte, ging man von weiteren 25 Jahren aus. Man hofft, die Algen irgendwann in normalen Erdölraffinerien aufarbeiten zu können. Und auch bei Exxon sieht man das Potential für die Produktion von Grundstoffen für die chemische Industrie.
Beobachter sehen hinter Exxons Motivation zum einen den längerfristigen Versuch der Schaffung einer Alternative zu Elektroautos, zum anderen einen kurzfristigen Greenwash-Versuch anderer Unternehmensaktivitäten.
Fazit
Sollen Mikroalgen tatsächlich in großem Stil kultiviert werden, müssen die dabei entstehenden Risiken gegen mögliche zu erreichende Positiva abgewogen werden.
Die Kritiker von Biofuelwatch sehen eine gewisse Berechtigung der Nutzung möglichst lokaler Mikroalgenarten in der Produktion ausgewählter Zusätze funktioneller Nahrungsmittel, als Fischfutter in der Aquakultur oder in der Abwasserbehandlung. Die kommerzielle Produktion von Biokraftstoffen hingegen hat sich nach bisherigem Wissensstand als Sackgasse erwiesen. Die dafür immer noch aufgewendeten Fördermittel fänden woanders eine bessere Verwendung, zum Beispiel bei der Erforschung von zukunftsfähigen Transportkonzepten.
Bis eine praktikable Lösung gefunden ist, scheint es bisher nur eine Verwendung von Algenölen im Personentransport zu geben: über ihre Umwandlung in Polyalkohole, die zu Polyurethanen verschäumt und anschließend zu Surfbrettern verarbeitet werden.
